我院江蘇省中藥高效給藥系統工程技術研究中心近年來緻力于智能型仿生多功能納米藥物遞送系統的構建,着力解決中藥複方生物利用度低、病竈部位靶向性差等問題,為中藥活性組分的高效遞送以及複雜疾病的精準治療提供思路。團隊王若甯副教授研究小組在狄留慶教授指導下在國際知名學術期刊ACS Nano(IF:18.027,中科院分區1區)在線發表最新研究成果。
由于血腦屏障(blood brain barrier, BBB)和血腦腫瘤屏障(blood brain tumor barrier, BBTB)的存在,大部分候選藥物無法有效地蓄積在腦膠質瘤病竈部位。此外,免疫抑制微環境也是腦膠質瘤治療的一大阻礙。因此,多策略聯合克服膠質瘤的治療阻礙至關重要。基于前期工作基礎(Acta Pharmaceutica Sinica B. 2022, Journal of Controlled Release. 2022. 2023, Journal of Medicinal Chemistry. 2022, Journal of Nanobiotechnology. 2020),發現血清來源的外泌體(Exosome,EXO)表達有豐富的TfR,其可以通過與血液中遊離的轉鐵蛋白結合,進而靶向大腦。由于EXO是内源性物質,所以相比于其它常用的納米載體具有更低的免疫原性,并且能夠逃避單核巨噬系統的吞噬,從而實現在體内的長循環。傳統中藥丹參中的脂溶性活性成分與甘草中的兩親性活性成分可通過自組裝策略構建納米膠束(TanⅡA-GL nano-micelles, TGM),同時發揮不同組分間的協同治療作用。受EXO獨特理化性質啟發,團隊将在EXO表面修飾了免疫佐劑CpG ODN 1826,成功構建了腦膠質瘤靶向及化療、免疫治療一體化的仿生納米遞送系統,用于遞送納米膠束(TGM),以“Immune Exosomes Loading Self-assembled Nano-micelles Traverse the Blood-brain Barrier for Chemo-immunotherapy Against Glioblastoma”為題發表于ACS Nano上。該研究制備所得荷載中藥自組裝膠束的“免疫外泌體”納米粒,可以有效改善單一載體藥物荷載量低、生物相容性差、靶向穿透力弱、治療機制單一等問題,能夠精準靶向腦膠質瘤病竈部位,通過化學療法和免疫療法協同治療腦膠質瘤,在未來具有廣闊的應用前景(Fig. 1)。
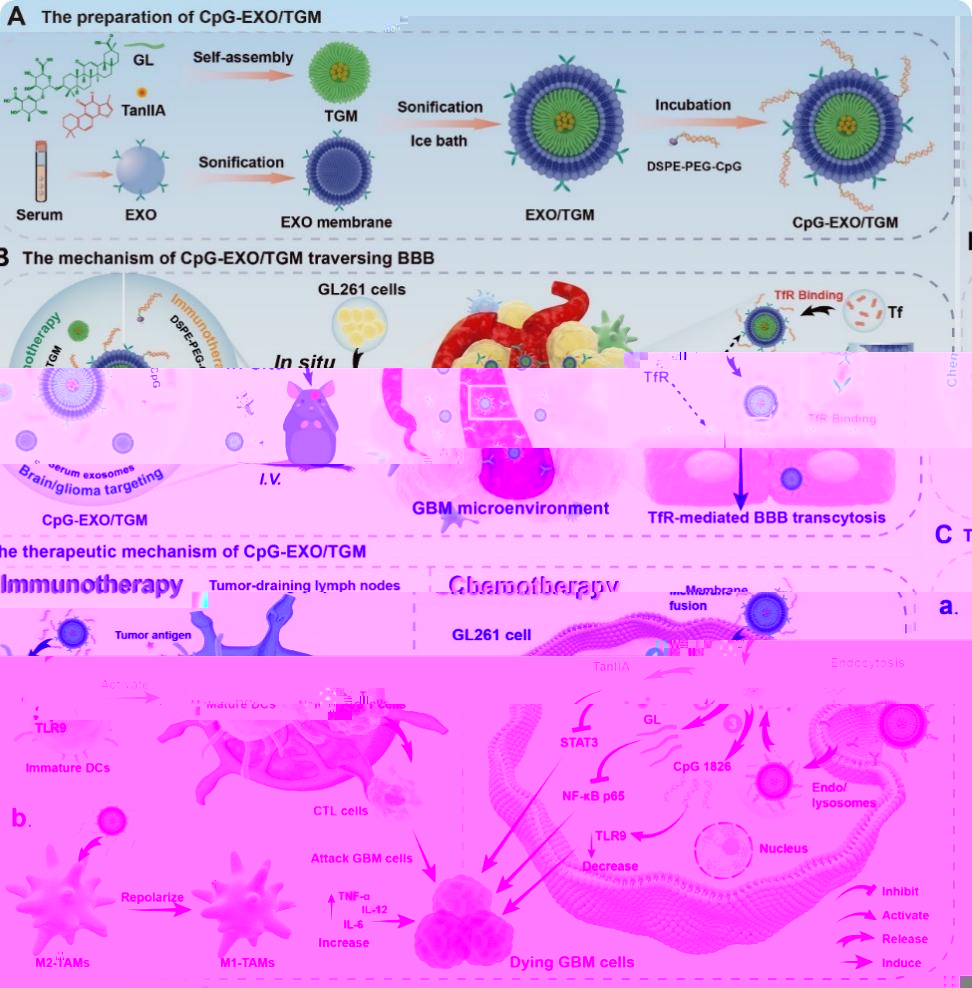
Fig. 1. The "immune exosome" nanoparticles of traditional Chinese medicine self-assembled micelles, CpG-EXO/TGM, treated brain glioma together through chemotherapy and immunotherapy.
上述研究獲得國家自然科學基金(81903557、82274104、82074024)、江蘇省自然科學基金(BK20190802)、江蘇省高等學校自然科學基金(19KJB350003)、江蘇省科協青年科技人才托舉工程、中華中醫藥學會青年人才托舉工程A類項目(No. 2021-QNRC2-A01)、bevictor伟德官网自然科學基金青年項目(NZY81903557)、bevictor伟德官网中藥學一流學科開放課題(2020YLXK019)等項目的資助支持。



